|
什么是蒸汽?
为了更好的理解蒸汽的特性,需要先了解物质的分子和原子结构形式,并以此了解冰、水和蒸汽的不同。
分子是任何元素在化学反应中存在的最小的单位,分子是由更小的原子组成的,例如氢原子和氧原子。
这些原子按照特定的组合组成了化合物,如化学式日2},就是由2个氢原子和一个氧原子组成的。
地球上水为什么这么丰富的原因主要是由于氢和氧是地球上最丰富的元素。另一种很重要的元素是碳,
它是有机物中的关键元素。
大多数矿物质以三种状态存在(固态、液态和气态),这被称为相。例如日20的三相分别为冰、水和蒸汽。
分子结构的相同仍不足以理解冰、水和蒸汽之间的区别,但如果了解这些分子是靠电荷力(氢键)紧密的结合在一起的,分子运动的活跃程度决定了物质的相,这样理解起来就容易的多。
三相点
某种物质的三相只能在某个特定温度和压力下达到平衡状态而共存,这就是三相点。
H20的三相点,也就是冰、水和蒸汽三相共存的点是273.16 K和绝对压力0.006112 bar。此压力非常接近绝对真空,如果在此温度下压力进一步下降,冰就会直接升华为蒸汽。
冰
冰的分子以点阵形式有序的排列,它们仅能在其平衡位置附近振动。在固体状态,分子运动仅限于在特定的位置上振动,振动的幅度不会超过分子直径。
热量的持续增加会导致分子振动加剧,并最终相互脱离,于是固体开始融化为液态(无论何种压力下总是在0℃时开始融化)。
冰融化时虽然发生了相变,但冰的温度并不上升,此时吸收的热量称为熔解热,相变现象是可逆的,当水结冰时会有同样多的热量释放到周围环境中。
对大多数物质来说,当由固态变为液态的时候,其密度将会下降。然而,日20是一个例外,当冰融化成水的时候,它的密度会增加,这就是为什么冰会浮于水上的原因。
水
在液态下,分子可以自由移动,但是由于相互之间的吸引力作用,其移动距离仍然小于一个分子的间距,分子之间的碰撞经常发生。不断增加的热量增加了分子运动和碰撞,并把液体的温度提高到汽化的温度,这个阶段吸收的热量称为水的液体怡或显热,这些热量把水由0℃加热到当前温度。
我们把0℃的水的怡定义为零,于是其它状态的怡就可以根据其参考状态得出。
水吸收热量引起了温度变化,这些热量被称为显热或液体怡和水怡。
在大气压下(0 bar g),水在100℃时沸腾,把1 kg水从。℃加热到100℃需要吸收419 kJ热量。由此可以推导出水的比热容Cp是 4.19 kJ/(kg " .℃).
蒸汽
当水的温度上升到它沸腾的状态,一些分子得到了足够的动能,具有了足够的速度,这样就可以在落回液体中之前从液体表面逸出。
继续加热使分子运动进一步加剧,大量的分子具有离开液面的动能,当水被加热到沸点时,气泡从水中逸出并在表面爆裂。
考虑到液体和气体的分子结构时,很显然蒸汽的密度比水低的多,因为蒸汽的分子之间距离要大的多,所以蒸汽会存在于水的表面以上的空间。
当离开液体表面的分子比那些重新进入液面的分子多的时候,水会自由蒸发。这时,它已经达到了它的沸点或饱和温度。
如果压力保持不变,增加更多的热量不会使水温上升,但会使水变成饱和蒸汽。同一系统的饱和水的温度和饱和蒸汽的温度是一样的,但是单位质量蒸汽中含有的热量要大的多。
在大气压力下饱和温度是1000C,但是,如果压力上升,将会吸收更多的热量,饱和温度也将上升,但是并不发生相变。
因此,增加压力有效增加了水的怡值和饱和温度,饱和温度和压力之间的关系见饱和蒸汽曲线(见2.2.1)。
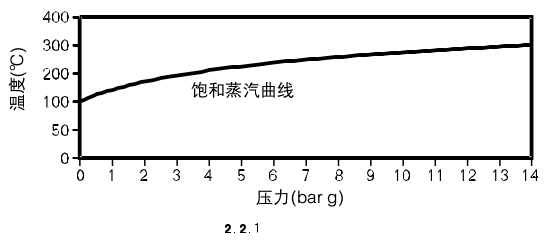
在该曲线上,水和蒸汽可以在任何压力下共存,饱和曲线以上的是过热蒸汽。
口饱和温度以上的温度称为蒸汽的过热度。
口饱和曲线下的水为过冷水。
如果蒸汽从锅炉中输出的速度与其产生的速度相同,继续增加的热量仅简单的增加了产量;如果蒸汽离开锅炉时受到阻挡,继续增加的热量仍然是那么多,则流入锅炉的能量要比流出的能量多,这样多余的能量就使压力上升,由于饱和温度和压力是相关的,于是饱和温度上升。
蒸发烩或潜热(}hrg)
这指的是在沸腾温度下水变成蒸汽需要吸收的热量,期间,水和蒸汽的混合物温度不上升,所有的能量用来把水由液态变为气态(饱和蒸汽)。
以前称之为潜热是因为汽化期间热量增加,而温度却没有变化,现在用的术语是蒸发怡。
正如从冰到水的相变过程,蒸发的过程也是可逆的。当蒸汽遇到较低温度的表面时,蒸汽冷凝会放出同样多的热量。当蒸汽作为加热用途时,通常就是利用这部分热量,也就是从蒸汽冷凝成凝结水所释放的热量。
饱和蒸汽烩或饱和蒸汽的总热量
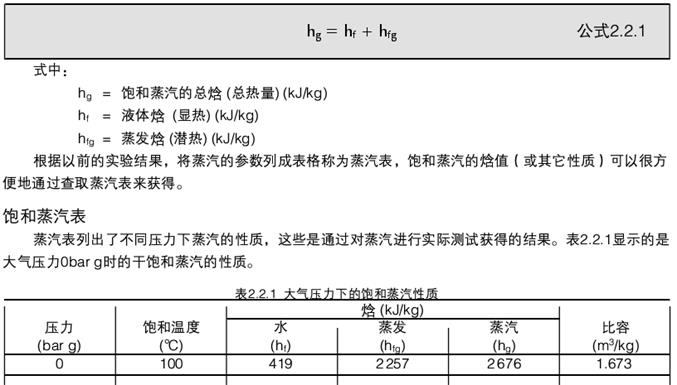
这是指饱和蒸汽的总能量,它是水的焙值和蒸发焙的总和。
例2.2.1
在大气压下(0 bar g),水在100℃时沸腾,把1kg水从。℃加热到100℃需要吸收419kJ的热量,因此,水从。℃到100℃的比怡是419 kJ/kg,正如上表中所示(见表2.2.2)0
如果把1 kg水从100℃全部加热变为100℃的蒸汽,需要再吸收2257kJ的热量,如蒸汽表中所示(见表2.2.2)。
因此:蒸汽的比怡hg = 419 + 2257
Obar g时的怡值hg=2676 kJ/kg
然而,大气压力下的蒸汽在实际应用中受到很大限制,这是因为此压力下的蒸汽无法在管道中输送到用汽点。
注意:由于蒸汽的压力和比容的关系,(比容随着压力上升而下降),通常锅炉中产生的蒸汽最少要7 bar g ,蒸汽在高压下产生可以使蒸汽输送管道保持在合理的尺寸。
随着蒸汽压力升高,蒸汽的密度同样也增大。由于比容是密度的倒数,则比容随着压力升高而降低。图2.2.2表示的比容和压力的关系,图中表明,低压下比容随压力变化非常大,而压力较高时比容变化比较小。
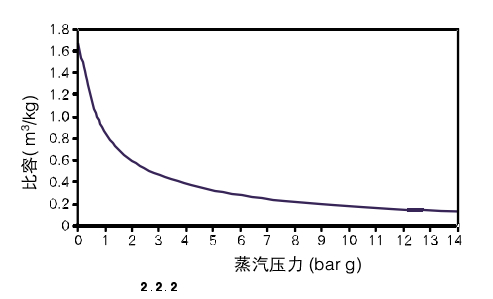
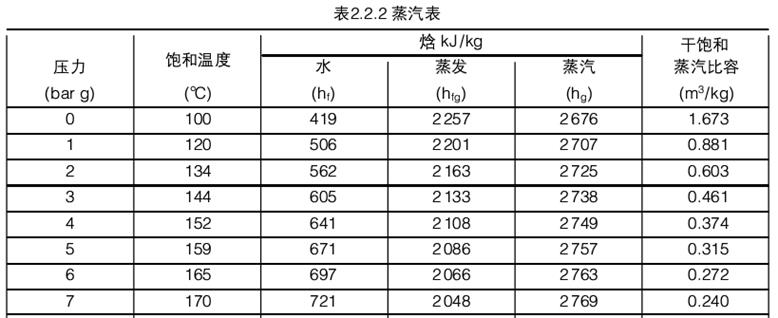
表2.2.2所示为部分蒸汽表,可以反映饱和蒸汽的比容和其它参数的关系:
在7 bar g时,水的饱和温度是1700C,此时把水加热到饱和温度需要的热量比大气压下要多,表中给出了把1 kg水从。℃加热到饱和温度170℃需要的热量为721 kJ0
在7 bar g时把水变为蒸汽需要的热量比大气压力下的需要的热量少,这是因为蒸汽压力上升导致蒸发怡下降。
但是,由于比容同样随着压力升高而降低,相同体积的蒸汽的传热量实际上是随着蒸汽压力上升而增加的。
干度
在某个压力下,具有沸点温度的蒸汽被称为干饱和蒸汽。然而,在工业锅炉中产生100%干燥的蒸汽几乎是不可能的,所以,这些蒸汽通常含有小水滴。实际上,当蒸汽在水的表面破裂时,由于紊流和液体飞溅,蒸汽空间里实际是小水滴和蒸汽的混合物。
在锅壳式锅炉(见第3章)中,热量仅传递给水,且蒸汽汽泡表面与水接触,所以产生的蒸汽一般含有5%的水。如果蒸汽中水分的质量份额为5%,那么就说蒸汽是95%干燥,干度系数为0.950
湿蒸汽的实际蒸发怡是干度(劝和蒸发怡( h,g)的乘积,湿蒸汽含有的可用能量比干饱和蒸汽少。
当水从。℃加热到饱和温度时,直到吸收到所有的液体怡h, (A一B)之前,其状态一直是沿着饱和水线变化。如果继续加热,饱和水会保持饱和温度不变的情况下继续吸热发生相变,直至吸收全部蒸发怡后,全部变为饱和蒸汽hfe(B-C)}
在此期间,当汽水混合物干度增加时,其状态沿饱和水线向饱和蒸汽线移动,因此,在此两个状态正中的位置,干度x为0.5。同样的,在饱和蒸汽线上的蒸汽干度为100%。当它吸收到所有的蒸发怡,它到达了饱和蒸汽线,如果在此后仍继续吸热,蒸汽的温度就会继续升高并过热(c一D)o
饱和水线和饱和蒸汽线形成了一个区域,在其中,蒸汽和水共同存在称为湿蒸汽。在饱和水线左边仅有水存在,在饱和蒸汽线右边全部为过热蒸汽。
饱和水线和饱和蒸汽线的交点为临界点,压力越靠近临界点,蒸发烩就越少,在临界点上,蒸发怡为零。也就是说,在临界点上,水直接变为饱和蒸汽。
在临界点以上仅有气体存在。气态时分子运动几乎不受到限制,当压力降低的时候,体积会增大。
临界点是液体能够存在的最高温度,在临界点以上对气体进行定温压缩,蒸汽不会产生相变。
在临界点以下对蒸汽进行定温压缩,蒸汽就会从过热区域进入湿蒸汽区域而液化。
在374.15℃和221.2 bar a时达到蒸汽的临界点。在此压力以上的蒸汽被称为超临界,没有确切定义的沸腾点。
闪蒸蒸汽
闪蒸蒸汽传统上指的是从冷凝水罐排放和直接向大气排放的蒸汽疏水阀排放口排出的蒸汽。那么,水是如何在不额外增加热量的情况下而变成蒸汽的呢?
闪蒸蒸汽发生于高压的水(水温高于低压时的饱和温度)变为低压的时候。如果高压水的温度低于低压水的饱和温度,那么闪蒸蒸汽就不会产生。当冷凝水从蒸汽疏水阀经过的时候,通常上游温度足够高,就会产生闪蒸蒸汽,见图2.2.40
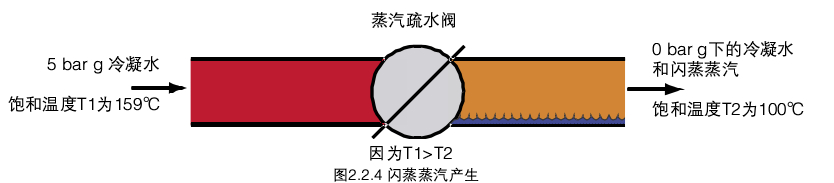
1 kg冷凝水(5bar g)饱和温度为1590C,通过蒸汽疏水阀后压力为。bar g , 1 kg冷凝水在5 bar g时具有
的能量是671 kJ,根据热力学第一定律,低压侧的冷凝水含有的能量与高压侧的能量必然相同,遵守能量守恒定律。
因此,低压侧的冷凝水的能量同样也是671 kJ,但是,0 bar g的水中最多含有419kJ热量,低压侧的能量就与高压侧不平衡,多余671-419=252 kJ,这样,对水来说,就会产生过热。这些过剩的热量就会使部分冷凝水沸腾形成闪蒸蒸汽,这个沸腾的过程就叫闪蒸。因此,原来存在于高压侧冷凝水中的能量现在就存在于低压侧的水和蒸汽的混合物之中了。
一定量的水在5 bar g压力159℃的饱和温度时,含有671 kJ/kg热量,如果此时压力降为大气压力(0 barg),此时,水的最高温度仅为1000C,含有419 kJ/kg热量。其间的差额为671一419 = 252 kJ/kg热量,就
会在大气压力下产生闪整蒸汽:
因此:产生的闪蒸蒸汽-
671-419
闪蒸蒸汽份额=。.112 kg蒸汽/kg水(或11.2%
产生的闪整蒸汽的比例是过剩的热量与最终压力下的蒸发怡的比值。
例2.2.4此例子中高压冷凝水的温度低于低压饱和温度
和例2.2.3一样的压力,但是,高压冷凝水的温度为900C,低于大气压力下的饱和温度1000C,注意:实际应用中很少有与饱和温度相差如此大的情况存在(159℃到900C),这里仅是为了说明在这种条件下闪蒸蒸汽无法产生。
此例子中,1 kg不饱和冷凝水在5bar g及90℃的液体怡为377 kJ,这个怡值小于大气压力下的饱和水的怡值,因此没有过多的热量去产生闪蒸蒸气,冷凝水仅以液态从疏水阀中通过,仅压力降低而已,本例中为大气压力。
90℃的蒸汽压力为0.7 bar绝对压力,如果二次侧压力低于这个压力,闪蒸蒸汽仍然会产生。
两个过程状态之间的能量转化和质量守恒
能量转化和质量守恒定律可从不同的方向来解释闪蒸蒸汽的产生。
考虑例2.2.3中的条件:
1 kg 5 bar g和159℃的冷凝水产生大气压下。.112kg闪蒸蒸汽,这可以由2.2.6的图示所示的来说明,闪蒸蒸汽和冷凝水的质量总和仍然是lkgo
能量守恒定律要求低压侧的总能量必须等于高压侧的总能量,因此,闪蒸蒸汽和冷凝水中的能量总和必须等于671 kJ o
从蒸汽表中可以得到以下信息:
大气压下饱和水的总怡(hr)=419 kJ/kg
大气压下饱和蒸汽的总怡(hg)=2 675 kJ/kg
因此在。bar g状态下,
水中的总怡=0.888kgx419kJ/kg=372 kJ (A)
蒸汽中的总怡=0.112kgx2675kJ/kg=299 kJ (B)
低压下水和蒸汽中的总怡=A+B=671 kJ
因此,根据蒸汽表,低压侧的焙值与高压侧的相同,这也就证明了能量守恒定律。 以上内容由彪维公司(www.bilwe.com)编写,转载请注明文章出处。 |
 全国服务电话:021-51602737
全国服务电话:021-51602737
 全国服务电话:021-51602737
全国服务电话:021-51602737